研究背景
手性光学是一门研究手性物质与光子之间的相互作用的学科。对于具有特定几何结构或空间点阵的物体,若其镜像无法与本体重合,则称该物体具有手性。从生活中到处可见的钥匙、藤蔓植物、弹簧到生物分子如氨基酸、碳水化合物、蛋白质等,非对称的手性物质存在于自然界的方方面面。事实上,手性特征是生命得以运行的重要载体,所有21种生命所必须的氨基酸都是左手手性的(L-enantiomers),新陈代谢、药物代谢等生命活动通常在特定手性的生物分子之间发生。例如,药物沙利度胺(Thalidomide)的R-(+)构型具有中枢镇静作用,是典型的抗妊娠反应药物,而其对映体S-(-)则对胎儿具有强烈的致畸性。目前手性处方类药物已占据了56%的市场份额,因此生产、制备以及区分不同手性的生物分子已成为制药业最重要的课题之一。生物分子的手性特性,以及其衍生的具有各类对称性结构的物质的物理化学性质已经成为生命科学学科的前沿领域。传统上人们利用材料的光学圆二色性现象(Circular Dichroism,CD)对手性分子进行探测与区分。然而,大部分生物分子的偶极矩很弱,上述光学现象通常需要高浓度溶液、较强激发光,或者精密的分析仪器才能较为清晰地观测到。因此,研发具有低成本、高效率的手性探测与成像平台仍是该领域未来研究的热点和重点之一。
综述速览
近日,香港城市大学雷党愿副教授团队在材料领域权威期刊《Advanced Materials》上发表了题为“Chirality Transfer from Sub-Nanometer Biochemical Molecules to Sub-Micrometer Plasmonic metastructures: Physiochemical Mechanisms, Biosensing, and Bioimaging Opportunities”的综述。该综述从亚纳米尺寸手性分子-亚微米尺寸金属结构相互作用的物理机理出发,着重梳理了近场电磁耦合效应、手性分子诱导合成与自组装、分子结构转化三种手性信号的转移放大机理,并归纳了各种机理在手性生物传感和成像中的应用(图1)。最后,文章指出了手性纳米光子学在未来实际应用方面所面临的挑战,并在理论研究、光学测量、大规模合成等方面进行了展望。论文主要作者包括中山大学曹兆龙副教授和香港理工大学博士生高涵(并列第一),通讯作者为香港城市大学雷党愿副教授,合作者包括香港理工大学副校长黄国贤讲座教授、电机工程学系靳伟讲座教授、电机工程学系博士后邱孟博士以及中山大学电子与信息工程学院、光电材料与技术国家重点实验室副主任邓少芝教授。论文工作受到了香港研究资助局、国家自然科学基金、香港城市大学和香港理工大学的资助。
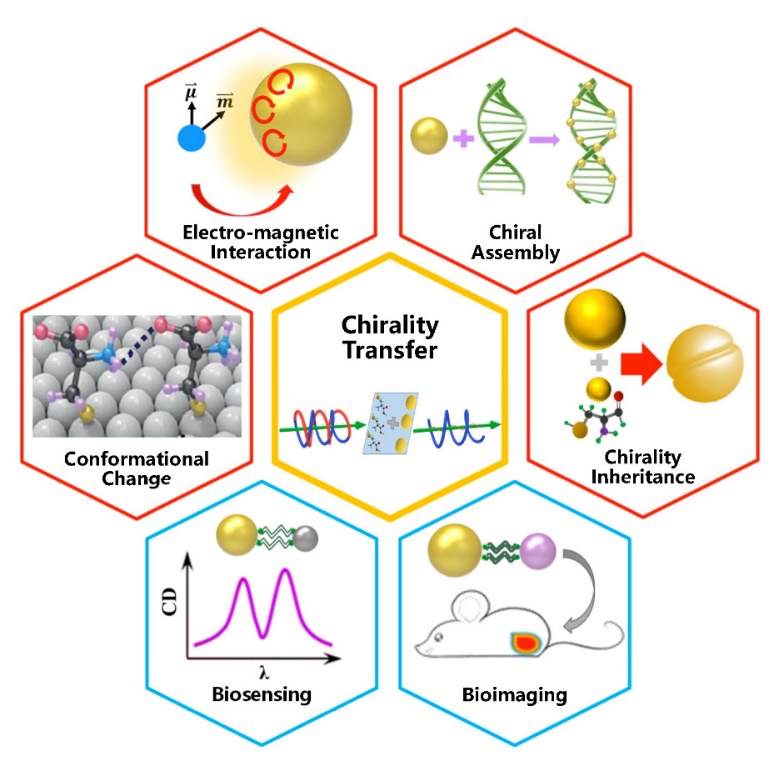
图1:手性传递机理的四种方式及其生物传感和成像应用
创新研究
近年来人们发现通过将表面等离激元共振与分子手性有机结合,可以将尺度在纳米甚至亚纳米的手性分子发出的信号转移并放大至非手性的亚微米金属结构等离激元共振信号中。综述归纳并整理了上述现象的物理机制,提出其关键点在于如何描述手性分子与金属结构的近场电磁相互作用(图2)。具体来说,手性分子可以简化为具有非垂直的电偶极子与磁偶极子的二能级系统(图2a),或在不同手性光照射下具有不同有效介电常数的介质小颗粒(图2b)。当手性分子位于高电磁场能量密度的区域,如金属纳米颗粒表面、金属狭缝热点(hotspot)以及纳米核壳结构夹层等时,其分子-金属颗粒聚合体可以在外界光激发下诱导局域表面等离激元手性电流,实现手性信号在等离激元共振波段的放大与增强。
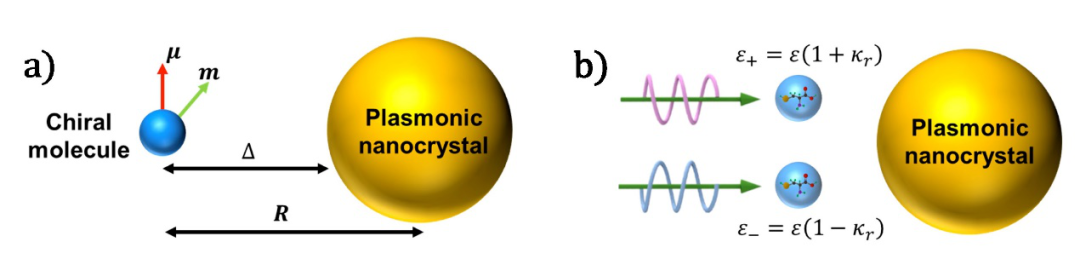
图2:近场电磁耦合机理示意图
图3为一典型近场电磁耦合手性转移结构[1]:当金属纳米棒以头碰头(ETE,图3a)或肩并肩(SBS,图3c)排列时,其颗粒-颗粒区域可产生具有高局域能量密度的狭缝热点表面等离激元共振模式。该共振模式因其共振频率、电磁场局域及增强强度可通过金属纳米颗粒几何结构调控而广受关注。通常来说,肩并肩结构由于可以容纳更多手性分子而产生更强的手性增强效应。然而,雷党愿研究组最近的一项系统性研究发现,该结构的手性增强效应其实受到局域电磁场增强与热点区域内手性分子数目的竞争调制。例如,金银核壳结构的纳米颗粒形成的头碰头结构相距更近,并且银颗粒通常比金颗粒激发的狭缝电场更强,上述成因克服了由于狭缝中减少的手性分子带来的影响,最终实现了更高效的手性信号转移效应(图3d-f)。

图3:金属狭缝热点表面等离激元共振产生的手性转移示意图[1]
除此之外,综述亦分析并对比了金属纳米颗粒表面特征以及纳米核壳结构夹层等结构在手性转移过程中的物理效应(图4)。具体包括:手性分子包裹球对称金属纳米颗粒、DNA-Au@Ag核壳纳米立方体、核-空隙-壳纳米颗粒复合体、远场电磁耦合效应以及空间穿透手性转移等。
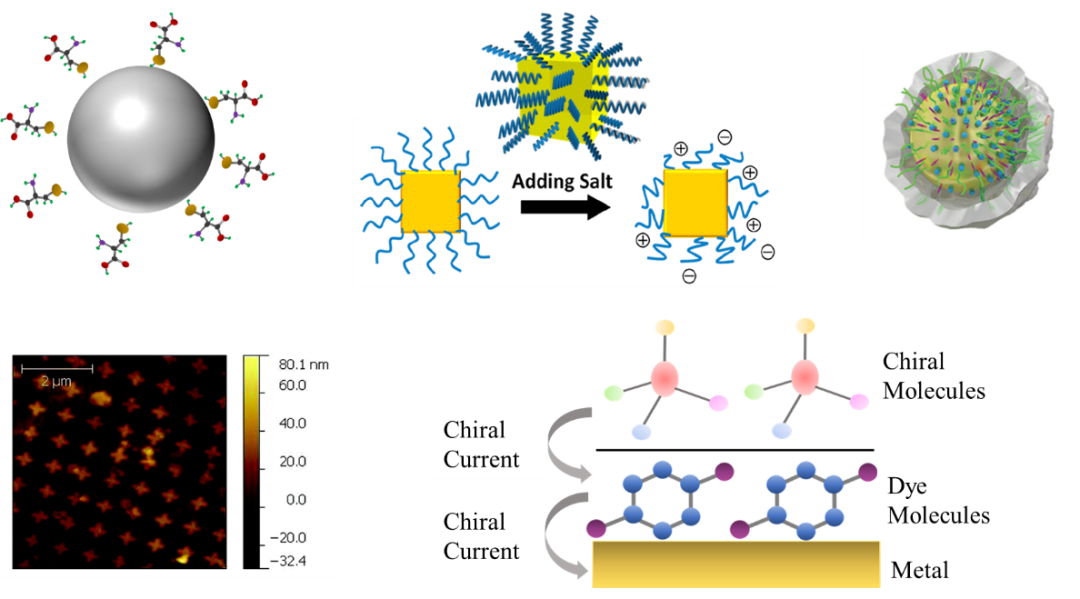
图4:其它基于近场电磁耦合效应的手性信号转移放大系统
 客服热线:
客服热线: